Сероводород в зависимости от концентрации оказывает как положительное, так и отрицательное действие на жизнедеятельность организма и его физиологические процессы. Это химическое соединение может образовываться во внутренних средах или поступать из внешнего окружения. Влияние сероводорода на организм человека многогранное, как полезное, так и отравляющее, способное вызвать мгновенную смерть.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Сероводород многим известен как газ, обладающий дурным запахом тухлых яиц. Первые упоминания о сероводороде датируются 16 веком, когда в 1713 году итальянский врач Бернардино Рамадзини описал влияние сероводорода на организм человека в своем труде «De Morbis Artificum», или «Заболевания рабочих». В главе «Болезни очистителей уборных и выгребных ям» он описывает болезненное воспаление глаз, которое было распространено среди таких рабочих. Воспаление это часто приводило к присоединению вторичной инфекции, а иногда и к полной слепоте. Рамадзини предположил, что во время работы из разрушенных экскрементов выделяются неизвестные летучие кислоты, которые и вызывают раздражение глаз. Как известно в настоящее время, сероводород образуется везде, где органическое вещество подвергается гниению [20].
В 1863 году Феликс Гоппе-Зейлер исследовал влияние чистого сероводорода на кровь человека и по изменениям в видимой области спектра поглощения, соответствующей гемоглобину, обнаружил зеленый пигмент. Он назвал новую форму гемоглобина сульфгемоглобином. Эта находка в дальнейшем привела к рождению гипотезы о том, что сероводород наряду с нитритом натрия и оксидом углерода (угарным газом) является кровяным ядом. Однако в условиях in vivo этот пигмент так и не был обнаружен.
Непосредственные исследования биологического действия сероводорода начались на рубеже XX века, но посвящены они были преимущественному изучению токсических свойств сероводорода [20]. Рассматривать сероводород в качестве сигнальной молекулы, которая не только является токсическим агентом, но и участвует в регуляции функциональной активности различных клеток нашего организма, стали только в конце XX века. Начало исследованиям в этой области положили японские ученые Абе и Кимура, которые в 1996 г. впервые описали возможность синтеза сероводорода в тканях головного мозга и указали на его способность регулировать функции клеток [4].
Хотя сероводород был обнаружен в тканях головного мозга еще в 1980-х годах, первоначально его сочли за артефакт, который образовался вследствие быстрого увеличения концентрации сульфидов в тканях после смерти. При этом появление сероводорода связывали с его высвобождением из дисульфидных соединений серы (так называемых «sulfane sulfur») во время препарирования тканей [16].
В настоящее время сероводород отнесен к группе так называемых газотрансмиттеров — газообразных внутриклеточных сигнальных молекул, выполняющих в клетке специфические регуляторные функции. H2S хорошо растворим в липофильных веществах. Его растворимость в липидах в пять раз превосходит растворимость в воде, что обусловливает хорошую проникающую способность H2S через мембранные структуры клетки и не требует участия специальных ион-транспортных систем. Константа проницаемости (РМ) сероводорода через бислойные липидные мембраны достаточно высока и составляет 0.5±0.4 см/с (для сравнения РМ для кислорода составляет примерно 0.0050±0.0006 см/с) [17]. Это позволяет считать сероводород высоко доступной молекулой, эффективно осуществляющей свои функции внутри клеток.
Другими молекулами, входящими в группу газотрансмиттеров, являются хорошо известный монооксид азота (NO), а также монооксид углерода (CO).
Сероводород в воде из скважины
Чаще других сероводород в воде доставляет хлопоты владельцам скважин, гордо именуемых артезианскими. По утверждениям бурильщиков, пласты воды, насыщенной этим газом, залегают после мелового слоя. Дно, ил, стенки нечищеного колодца или скважины – также повышают риск загрязнения питьевой воды сероводородом.
Серные бактерии
Запах тухлых яиц не всегда связан с наличием сероводорода в воде. Производить его могут особые бактерии, которые превращают сульфат в воде в сероводород. Они безобидны, если вам нравится суп с запахом испорченных яиц или чай с таким же «ароматом». Особенно они любят теплые места, поэтому могут поселяться даже в кулерах.
Но есть и более опасные микроорганизмы, которые разлагают остатки органики в воде, выделяя сероводород и другие токсичные вещества. Такие бактерии и их продукты жизнедеятельности могут вызывать проблемы с пищеварительной системой, интокискаию организма.
Поэтому прежде чем очищать воду от H2S, рекомендуем сдать анализы, чтобы понять истинную причину запаха тухлых яиц в воде, и подобрать правильный фильтр от сероводорода и других загрязнений.
Синтез сероводорода
Внутриклеточный синтез сероводорода осуществляется в различных клетках нашего организма. В настоящее время известно три фермента, в результате работы которых синтезируется сероводород: цистотионин-β-синтаза (CBS), цистотионин-γ-лиаза (CSE) и 3-меркаптопируватсульфуртрансфераза (3-MST).
При этом CBS осуществляет синтез сероводорода преимущественно в нервных клетках. В гладкомышечных клетках кровеносных сосудов, сокращение-расслабление которых обеспечивает изменение тонуса последних, синтез сероводорода осуществляет фермент CSE [16], [22], а в эндотелиальных клетках, выстилающих изнутри просвет сосуда, — 3-MST [11], [21] (рис. 1).
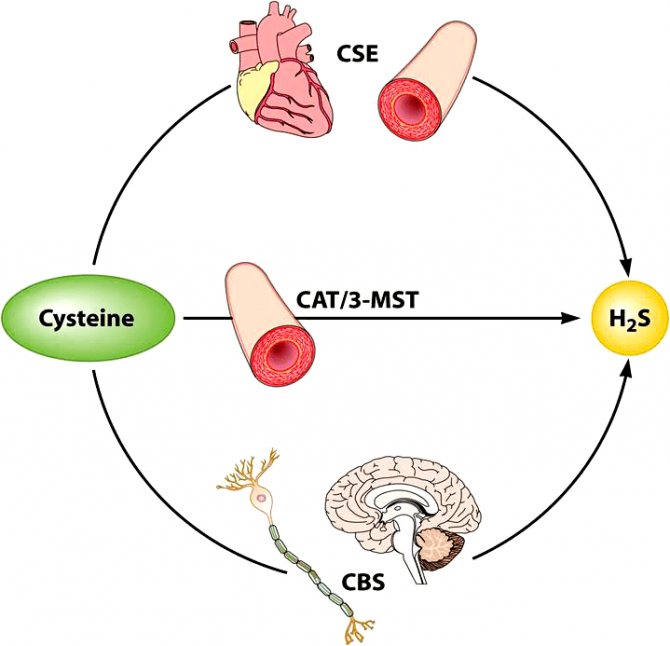
[16]
Все три фермента используют в качестве субстрата для синтеза сероводорода серосодержащую аминокислоту L-цистеин, катализируя реакцию его десульфгидратации: происходит отщепление от цистеина атома серы без последующего его окисления, что ведет к образованию H2S. Под действием CSE происходит преобразование цистина (дисульфид цистеин) до тиоцистеина, пирувата и аммиака, с последующим неферментативным преобразованием тиоцистеина до цистеина и H2S (рис. 2). В то же время, CBS использует несколько другой путь синтеза H2S, который заключается в конденсации гомоцистеина с цистеином, и последующим образованием цистатионина [16]. В качестве субстрата синтеза сероводорода могут использоваться и другие серосодержащие аминокислоты, такие как метионин и цистин.
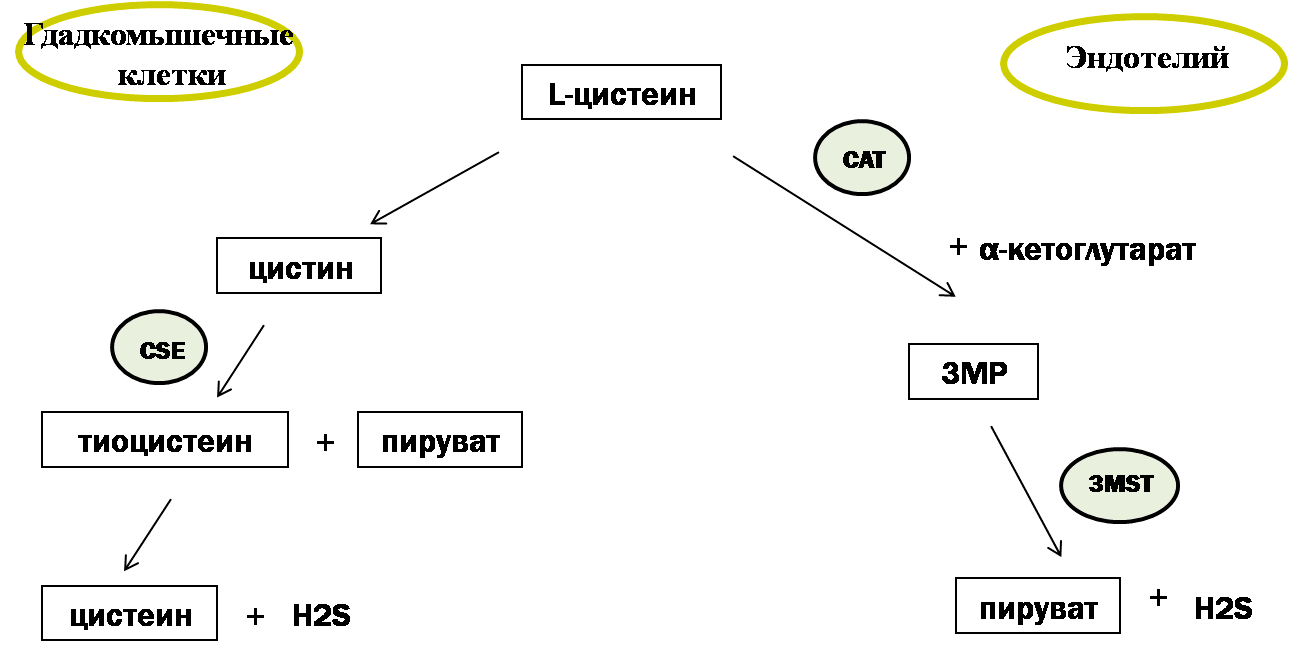
Фермент 3-меркаптопируват-сульфуртрансфераза (3MST) функционирует в комплексе с другим ферментом — цистеин-аминотрансферазой (CAT). Выделяют митохондриальную и цитозольную формы CAT. Используя в качестве субстрата серосодержащую аминокислоту L-цистеин и α-кетоглутарат, CAT продуцирует 3-меркаптопируват (3МР), из которого при участии фермента 3MST синтезируется непосредственно H2S [18]. В отсутствии α-кетоглутарата синтез H2S прекращается.
Как определить сероводород в воде?
Первый признак – это конечно же запах. Но для того, чтобы точно определить концентрацию и подобрать оптимальный способ очистки воды от сероводорода – нужно сдать лабораторный анализ. Поскольку это газ, который легко улетучивается, анализы нужно проводить на месте, либо образец воды, который будет передаваться в лабораторию, должен быть стабилизирован.
Если у вас возникают вопросы по поводу того, как определить сероводород в воде у вас – звоните. Наши консультанты дадут максимум информации.
Сероводород и сердечнососудистая система
Как показали многочисленные исследования, одной из систем, где сероводород играет ключевую роль как сигнальная молекула, является сердечнососудистая система, в частности — кровеносные сосуды. Осуществляя свое регуляторное действие в сосудах артериального русла, он принимает активное участие в регуляции артериального давления [23].
Исследования среди людей показали, что в группе лиц с нормальными показателями артериального давления уровень H2S в плазме крови составлял 34 мкМ, тогда как у больных артериальной гипертонией он был снижен до 20 мкМ. Назначение больным артериальной гипертонией ингаляций сероводорода способствовало снижению показателей артериального давления [29]. При проведении исследований на крысах было обнаружено, что внутривенное болюсное введение раствора сероводорода вызывало у них дозозависимое снижение артериального давления [16].
В условиях in vitro донор сероводорода гидросульфид натрия (NaHS), активно используемый в экспериментальной практике, также вызывал расслабление различных отделов артериального и венозного русла: грудной, мезентериальной, почечной артерий, аорты, воротной вены и т.д. Несмотря на существенную роль эндотелия в регуляции сосудистого тонуса, его удаление не оказывало существенного влияния на эффекты сероводорода в гладкомышечных клетках [16]. Это свидетельствует о прямом влиянии сероводорода на гладкомышечные клетки через присущие им регуляторные механизмы. Расслабляющее действие сероводорода на гладкомышечные клетки связано преимущественно с открыванием особых структур в их мембране — калиевых каналов, чувствительных к концентрации внутриклеточного источника энергии — аденозинтрифосфата (АТФ) [10], [28].
Связываясь с серосодержащими группами белков этих каналов, сероводород изменяет их пространственную конфигурацию и тем самым способствует открыванию каналов [2], [24]. Открывание калиевых каналов ведет к увеличению выхода ионов калия из клетки в межклеточную среду. В то же время, активации АТФ-чувствительных калиевых каналов сопровождается инактивацией потенциал-чувствительных кальциевых каналов L-типа, обеспечивающих поступление ионов кальция (Са2+) в клетку. Высокая внутриклеточная концентрация Са2+ является необходимым условием развития сократительного ответа со стороны мышечной клетки. Закрывание кальциевых каналов способствует снижению концентрации свободного внутриклеточного Са2+ [29]. Эти процессы в совокупности запускают механизмы расслабления в гладкомышечных клетках, что в конечном итоге приводит к снижению тонуса кровеносных сосудов и артериального давления в целом (рис. 3).
Рисунок 3. Влияние сероводорода на мембранные процессы. Сероводород, взаимодействуя с АТФ-чувствительными калиевыми каналами, вызывает их активацию и увеличение выхода ионов калия из клетки. Вследствие этого снижается мембранный потенциал на мембране (гиперполяризация) и инактивируются кальциевые каналы. В результате прекращения поступления в клетку ионов кальция происходит расслабление гладкомышечной клетки.
В регуляции релаксирующего действия сероводорода участвуют также и другие внутриклеточные молекулярные механизмы, однако их роль не столь выражена и однозначна [23].
В ряде исследований была отмечена интересная особенность сероводорода — его способность в низких концентрациях вызывать сокращение гладкомышечных клеток [1], [6], [15]. Согласно одной из гипотез сероводород связывается с хорошо известной эндотелиальной сигнальной молекулой оксидом азота, снижая тем самым его концентрацию [19], [25]. Снижение концентрации этих двух сосудорасслабляющих молекул является причиной увеличения тонуса сосудов артериального русла. Недавно было показано, что сократительный эффект сероводорода связан с активацией особого мембранного белка — Na+,K+,2Cl−-котранспортера (NKCC), обеспечивающего трансмембранный обмен ионов калия, натрия и хлора [3]. Перераспределение этих ионов является причиной развития сокращения.
Физиологическая роль сократительного эффекта сероводорода до конца не ясна: является ли он побочным продуктом каких-то внутриклеточных молекулярных реакций, или же несет на себе функциональную нагрузку? В первом случае увеличение тонуса сосудов может быть результатом взаимодействия сероводорода с активными формами кислорода, что приводит как к снижению концентрации самого сероводорода, так и образованию продуктов, способных вызывать сократительный ответ со стороны гладкомышечных клеток. Второй же случай предполагает специфическую активацию сероводородом ионных механизмов, направленных на развитие кратковременного локального спазма, например, в случае нарушения целостности сосудистой стенки [12].
С точки зрения токсикологии
Сероводород считается газом очень токсичным, как и все токсины, он воздействует непосредственно на печень, а также на почки и нервную систему. Решающее значение имеют концентрация и продолжительность воздействия, поскольку сероводород практически беспрепятственно способен проникать (всасываться) в организм через органы дыхания.
Попадая в организм, сероводород превращается в сульфат и блокирует дыхательный фермент цитохромоксидазу. Тем самым он предотвращает связывание с нею кислорода, что приводит к резкому замедлению метаболизма, а в больших количествах — остановке клеточного дыхания и клеточной гипоксии («удушью» на уровне клетки). При небольшой концентрации сероводорода в воздухе происходит возбуждение дыхательной системы. Так организм человека стремится компенсировать недостаток кислорода.
С повышением содержания этого газа начинается резкое угнетение системы дыхания. При концентрации сероводорода 1 грамм на кубометр воздуха (и выше), человека ждет мгновенная смерть. Правда, такие концентрации достигаются, к счастью, крайне редко и, как правило, только при промышленных авариях (утечках) в условиях замкнутого помещения.
Негативное влияние сероводорода на организм не ограничивается подавлением тканевого дыхания. Этот газ легко вступает в реакцию с ионами железа, содержащимися в составе молекул гемоглобина в крови. В результате образуется сульфид железа, кровь при этом «темнеет» и теряет способность транспортировать кислород.
Однако и на этом вред сероводорода для человека не заканчивается.
Доказано его пагубное влияние на нервную систему. Сероводород считается высокотоксичным нервным ядом. Избыточные концентрации этого газа приводят к чрезмерной стимуляции нейронов головного мозга. Систематическое вдыхание сероводорода вызывает беспокойство и депрессию. При постоянном нахождении в местности, где наблюдаются повышенная концентрация сероводорода в воздухе, у человека развиваются нарушения сна, психические расстройства, поражения вегетативной нервной системы.
Ринит, бронхит, слюнотечение, кератоконъюнктвит – верные спутники людей, подверженным воздействию даже небольших концентраций сероводорода. Также отравление сероводородом сопровождается снижением артериального давления, учащением сердцебиения, головной болью, головокружением, рвотой.
Дальнейшие перспективы
Учитывая роль сероводорода в регуляции тонуса кровеносных сосудов, ученые всего мира активно взялись за разработку лекарственных средств, действие которых основывалось бы на повышении или понижении в крови концентрации этого газотрансмиттера. В настоящее время возможные молекулы-кандидаты на роль лекарственных соединений можно разделить на две группы: молекулы, которые, растворяясь, непосредственно высвобождают сероводород (NaHS, Na2S, GYY4137) и молекулы-предикторы эндогенного синтеза сероводорода (N-ацетилцистеин, L-цистеин) [7].
N-ацетилцистеин и L-цистеин — предшественники синтеза эндогенного H2S. Увеличение внутриклеточной концентрации этих молекул вызывает дополнительную активацию ферментов CSE и CBS и, следовательно, усиление синтеза H2S. Существенным преимуществом этих молекул является практически полное отсутствие побочных эффектов. Однако трудности, связанные с регулированием конечной концентрации образующегося H2S, вносят свои ограничения на использование N-ацетилцистеина и L-цистеина в клинической практике [26].
Возможные молекулы-претенденты на роль нового лекарственного вещества должны обладать рядом свойств. Во-первых, они должны быть хорошо растворимы в воде. Во-вторых, не должны оказывать токсического действия. В-третьих, не должны быстро метаболизироваться в организме. И в-четвертых, обладать пролонгированным действием, что возможно при достаточно медленном высвобождении сероводорода молекулой-донором в условиях in vivo.
В настоящее время в экспериментальной практике наиболее часто в качестве донора сероводорода используются гидросульфид натрия (NaHS) и сульфид натрия Na2S. Однако при растворении этих молекул происходит слишком быстрое высвобождение сероводорода, что в условиях in vivo вызывает резкое падение артериального давления, вплоть до сосудистого коллапса [16]. Процесс высвобождения сероводорода в этом случае трудно контролируется, что делает NaHS и Na2S непригодными для использования в терапевтических целях.
Недавно Ли с соавторами [14] получили из реактива Лавессона новую молекулу-донор сероводорода, которую они обозначили как GYY4137 (рис. 4). В отличие от гидросульфида натрия, GYY4137 высвобождает сероводород постепенно, что делает эту молекулу более перспективной для дальнейших фармакологических исследований. В моделях на крысах в условиях in vivo и in vitro исследователи установили, что GYY4137 обладает сосудо-расслабляющими свойствами и оказывает антигипертензивное действие.
Рисунок 4. Схема синтеза GYY4137 из реактива Лавессона
Другим направлением в разработках «сероводородных» препаратов является встраивание сероводород-высвобождающих группировок в уже имеющиеся и широко используемые лекарственные молекулы. Альтернативные доноры сероводорода могут быть получены путем добавления сульфидных групп к нестероидным противовоспалительным препаратам. Например, S-диклофенак содержит тионовые группы, прикрепленные эфирными связями к молекуле-носителю, которые в растворе играют роль источника сероводорода [13]. Встраивание тиоловых группировок в молекулу силденафила приводит к развитию эффекта, связанного с существенной релаксацией гладкомышечных клеток кавернозных тел [7].
В последние годы большое внимание привлекли полисульфидные соединения чеснока. Были обнаружены их вазоактивные свойства: одно из соединений — диаллил дисульфид (DADS) — вызывало расслабление кольцевых сегментов аорты крысы. Полисульфидные соединения чеснока не только являются предшественниками H2S, но и способны самостоятельно вызывать изменения конформации молекул белков в клеточных мембранах.
Перспективной молекулой-донором сероводорода является получаемый из чеснока S-аллилцистеин, который обладает выраженным кардиопротекторным действием (рис. 5). Однако пока не до конца ясно, является ли он предшественником сероводорода или же модулирует функцию ферментов, связанных с синтезом последнего [26].
Рисунок 5. Серосодержащие соединения чеснока. Из чеснока получают два класса органических соединений серы: жирорастворимые (а) и водорастворимые (б) аллильные соединения серы, образующиеся из гликозида аллиина. Жирорастворимые аллильные соединения серы, такие как диаллил сульфид (DAS), диаллил дисульфид (DADS) и диаллил трисульфид (DATS) освобождаются из аллиина. Эта реакция катализируется ферментом аллииназой, который высвобождается при измельчении чеснока. Водорастворимые соединения серы (S-аллилцистеин (SAC) и S-аллилмеркаптоцистеин) получают при длительной инкубации дробленого чеснока в водных растворах.
С целью снижения патологически высокой концентрации сероводорода можно использовать ингибиторы ферментов его синтеза. К ним относится DL-пропаргилглицин, который, обладая высокими липофильными свойствами, легко проникает через мембрану клетки, не вызывая видимых ее повреждений. Однако DL-пропаргилглицин ингибирует не только CSE-фермент синтеза сероводорода в сердечнососудистой системе, но и CBS, что может стать причиной появления множества нежелательных побочных эффектов, связанных с нарушением регуляции функции других органов [26].
Таким образом, существующие в настоящее время наработки в области создания доноров сероводорода, пригодных для использования в терапевтических целях, находятся на ранней стадии своего развития и явно недостаточны. Разработка, синтез и описание свойств новых доноров сероводорода и селективных ингибиторов ферментов его эндогенного синтеза имеет чрезвычайно важное значение для создания новой группы лекарственных препаратов и, возможно, позволит продвинуться вперед в борьбе с сердечно-сосудистыми заболеваниями [5].
Гибернация у животных и странное вето
Ряд исследователей предположили, что, помимо других физиологических ролей, сероводород может использоватья организмом для естественной саморегуляции скорости метаболизма (метаболической активности), температуры тела и потребления кислорода.
Учёных давно интересовала проблема анабиоза (способности приостанавливать жизненные процессы и затем возобновлять их) у человека. Процесс, известный как гибернация или «зимняя спячка», наблюдается в природе у многих видов млекопитающих, а также у жаб. Учёные знали, что, что во время «зимней спячки» у животных продукция эндогенного сероводорода значительно повышается.
Состояние живого организма, при котором жизненные процессы (обмен веществ и др.) настолько замедлены, что отсутствуют все видимые проявления жизни — это вовсе не научная фантастика, а дело времени.
Учёные решили в экспериментах «пойти от противного», и воздействуя небольшими дозами сероводорода на организм млекопитающего, попытаться вызвать замедление метаболических процессов. Как обычно, начали исследования с мышей.
В 2005 году было показано, что мышь можно погрузить в состояние искусственной гипотермии, то есть, почти анабиоза, подвергнув её воздействию низких концентраций сероводорода во вдыхаемом воздухе. В результате дыхание животных замедлялось со 120 до 10 дыхательных движений в минуту, а их температура тела падала с 37 градусов Цельсия до уровня, всего на 2 градуса Цельсия превышающего температуру окружающей среды. Иными словами, эффект был таков, как будто теплокровное животное внезапно становилось холоднокровным.
Учёные посчитали, что теоретически, если бы удалось заставить вызываемую сероводородом гибернацию столь же эффективно работать у людей, это могло бы быть очень полезным в клинической практике для спасения жизни тяжело травмированных или перенёсших тяжёлую гипоксию, инфаркты, инсульты больных, а также для консервации донорских органов.
У мыши, погруженной в подобное состояние примерно на 6 часов, никаких негативных последствий для здоровья, нарушений поведения или каких-либо повреждений внутренних органов обнаружено не было. В 2006 году было также выяснено, что артериальное давление у мыши, подвергнутой подобным образом воздействию сероводорода, также существенно не снижается.
Исследования «сероводородного анабиоза» на теперь уже разных видах животных, продолжались ещё несколько лет, после чего учёные высказали сомнения в том, что эффекта гибернации и гипометаболизма при помощи сероводорода возможно достичь у более крупных животных. В 2008 году тот же эффект на свиньях и овцах воспроизвести не удалось. Это привело исследователей к заключению, что эффект, наблюдаемый у мышей, не наблюдается у более крупных животных, а следовательно, и к человеку применим быть не может.
Однако, в феврале 2010 года руководивший исследованиями учёный Марк Рот заявил на конференции, что вызванная сероводородом гипотермия у человека прошла I фазу клинических испытаний. После чего, в августе 2011 года, ещё до начала набора участников для следующих этапов исследований, решение о проведении дальнейших клинических испытаний на больных с инфарктом было отозвано компанией самого учёного (Ikaria), без объяснения причин.
Химические свойства сероводорода. Химические реакции (уравнения) сероводорода:
Основные химические реакции сероводорода следующие:
1. реакция взаимодействия сероводорода и брома:
H2S + Br2 → 2HBr + S.
В результате реакции образуются бромоводород и сера. В ходе реакции используется насыщенный раствор сероводорода.
2. реакция взаимодействия сероводорода и йода:
H2S + I2 → 2HI + S.
В результате реакции образуются йодоводород и сера. В ходе реакции используется насыщенный раствор сероводорода.
3. реакция взаимодействия сероводорода и кислорода:
2H2S + O2 → 2S + 2H2O.
В результате реакции образуются сера и вода. Реакция протекает медленно на свету, в растворе или в газовой фазе. Сероводород в ходе реакции используется в виде насыщенного раствора. На данной реакции основан промышленный способ получения серы.
4. реакция горения сероводорода:
2H2S + 3O2 2SO2 + 2H2O (t = 250-300 °C).
В результате реакции образуются оксид серы и вода. Реакция горения сероводорода на воздухе.
5. реакция взаимодействия сероводорода и озона:
H2S + O3 → SO2 + H2O.
В результате реакции образуются оксид серы и вода. Сероводород в ходе реакции используется в виде газа.
6. реакция взаимодействия сероводорода и кремния:
Si + 2H2S SiS2 + 2H2 (t = 1200-1300 °C).
В результате реакции образуются сульфид кремния и водород.
7. реакция взаимодействия сероводорода и цинка:
H2S + Zn ZnS + H2 (t = 400-800 °C).
В результате реакции образуются сульфид цинка и водород.
8. реакция взаимодействия сероводорода и алюминия:
2Al + 3H2S Al2S3 + 3H2 (t = 600-1000 °C).
В результате реакции образуются сульфид алюминия и водород.
9. реакция взаимодействия сероводорода и галлия:
2Ga + H2S → Ga2S + H2.
В результате реакции образуются сульфид галлия и водород.
10. реакция взаимодействия сероводорода и молибдена:
Mo + 2H2S MoS2 + 2H2 (t > 800 °C).
В результате реакции образуются сульфид молибдена и водород.
11. реакция взаимодействия сероводорода и бария:
Ba + H2S BaS + H2 (t > 350 °C).
В результате реакции образуются сульфид бария и водород.
12. реакция взаимодействия сероводорода и магния:
Mg + H2S MgS + H2 (t = 500 °C).
В результате реакции образуются сульфид магния и водород.
13. реакция взаимодействия сероводорода и германия:
Ge + H2S GeS + H2 (t = 600-800 °C).
В результате реакции образуются сульфид германия и водород.
14. реакция взаимодействия сероводорода и кобальта:
Co + H2S CoS + H2 (t = 700 °C).
В результате реакции образуются сульфид кобальта и водород.
15. реакция взаимодействия сероводорода и серебра:
2Ag + H2S → Ag2S + H2.
В результате реакции образуются сульфид серебра и водород.
16. реакция взаимодействия сероводорода и оксида лития:
Li2O + H2S Li2S + H2O (t = 900-1000 °C).
В результате реакции образуются сульфид лития и вода.
17. реакция взаимодействия сероводорода и оксида цинка:
ZnO + H2S ZnS + H2O (t = 450-550 °C).
В результате реакции образуются сульфид цинка и вода.
18. реакция взаимодействия сероводорода и оксида железа:
FeO + H2S FeS + H2O (t = 500 °C).
В результате реакции образуются сульфид железа и вода.
19. реакция взаимодействия сероводорода и оксида молибдена:
MoO2 + 2H2S MoS2 + 2H2O (t = 400 °C).
В результате реакции образуются сульфид молибдена и вода.
20. реакция взаимодействия сероводорода и гидроксида натрия:
H2S + 2NaOH → Na2S + 2H2O.
В результате реакции образуются сульфид натрия и вода. В ходе реакции используется концентрированный раствор гидроксида натрия.
21. реакция взаимодействия сероводорода и гидроксида бария:
Ba(OH)2 + H2S → BaS + 2H2O.
В результате реакции образуются сульфид бария и вода. В ходе реакции используется разбавленный раствор сероводорода.
22. реакция взаимодействия сероводорода и гидроксида меди:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди и вода. В ходе реакции используется насыщенный раствор сероводорода и гидроксид меди в виде суспензии.
23. реакция взаимодействия сероводорода и азотной кислоты:
H2S + 2HNO3 → S + 2NO2 + 2H2O.
В результате реакции образуются сера, оксид азота и вода. В ходе реакции используется насыщенный раствор сероводорода и концентрированный холодный раствор азотной кислоты.
Аналогичные реакции протекают и с другими минеральными кислотами.
24. реакция взаимодействия сероводорода и карбоната кальция:
CaCO3 + H2S CaS + H2O + CO2 (t = 900 °C).
В результате реакции образуются сульфид кальция, оксид углерода и вода.
25. реакция взаимодействия сероводорода и карбоната бария:
BaCO3 + H2S BaS + CO2 + H2O (t = 1000 °C, kat = H2).
В результате реакции образуются сульфид бария, оксид углерода и вода.
26. реакция взаимодействия сероводорода и карбоната натрия:
H2S + Na2CO3 → NaHS + NaHCO3 (t = 1000 °C, kat = H2).
В результате реакции образуются гидросульфид натрия и гидрокарбонат натрия. В ходе реакции используется насыщенный раствор сероводорода.
27. реакция взаимодействия сероводорода и нитрата серебра:
2AgNO3 + H2S → Ag2S + 2HNO3.
В результате реакции образуются сульфид серебра и азотная кислота. В ходе реакции используется насыщенный раствор сероводорода.
28. реакция взаимодействия сероводорода и нитрата висмута:
2Bi(NO3)3 + 3H2S → Bi2S3 + 6HNO3.
В результате реакции образуются сульфид висмута и азотная кислота. В ходе реакции используется насыщенный раствор сероводорода.
29. реакция взаимодействия сероводорода и нитрата свинца:
Pb(NO3)2 + H2S → PbS + HNO3.
В результате реакции образуются сульфид свинца и азотная кислота. Данная реакция является качественной реакцией на сероводород. В результате реакции образуются соль свинца – сульфид свинца черного цвета, который выпадает в осадок.
30. реакция термического разложения сероводорода:
H2S H2 + S (t = 400-1700 °C).
В результате реакции образуются водород и сера. В ходе реакции используется насыщенный раствор сероводорода.
Условия отбора пробы на сероводород
Для того чтобы провести анализ на сероводород, необходимо правильно собрать материал:
- Взять в лаборатории тару, содержащую специальный концентрат – ацетат цинка
- Слить воду сильным напором в течение 5-10 минут
- Настроить напор тонкой струей
- Отобрать 1,5-2 литра исходной воды в полученную тару с консервантом
- Наполнить тару до краев, закрыть крушкой и «выдавить» весь воздух из тары
- В течение 24 часов доставить в лабораторию
Какие существуют степени отравления
Вдыхая воздух, содержащий сероводород, можно серьезно пострадать. Особенно если концентрации газа высокие. Чем опасен сероводород в воздухе? На сегодня выделены несколько степеней отравления.
1. Легкая. Симптомы:
- жжение, резь в глазах;
- слезоточивость;
- раздражение от источников света;
- рвотные позывы;
- навязчивый кашель;
- насморк.
2. Средняя. К вышеперечисленным признакам добавляются:
- головная боль;
- обильная рвота, тошнота;
- головокружение;
- сильная слабость или, наоборот, возбуждение;
- координация движений нарушена.
3. Тяжелая. Симптомы:
- синюшный цвет лица;
- рвота;
- удушье;
- нарушение сердечного ритма.
Тяжелое отравление может привести к коме, а в отдельных случаях и к летальному исходу.